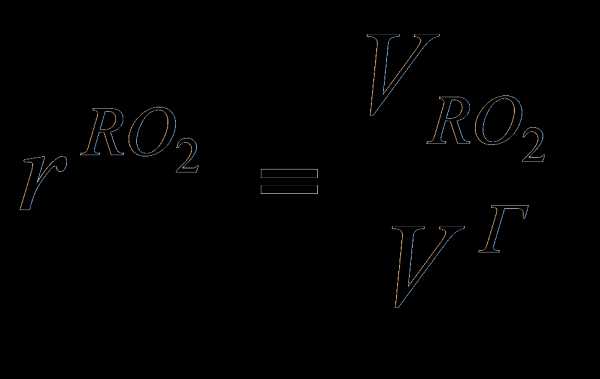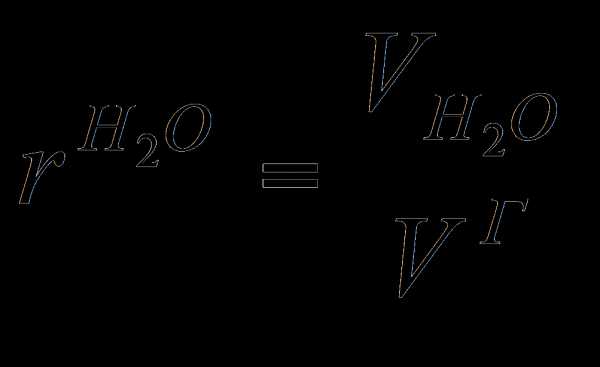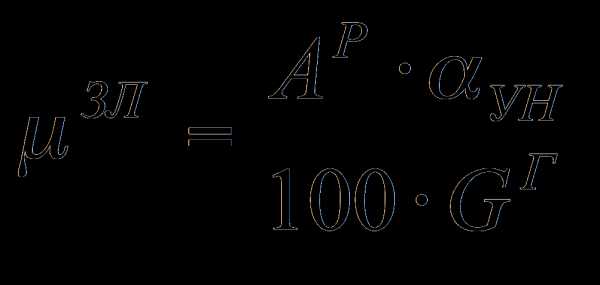- 8 (495) 7487600
- 8 (495) 7487600
- 8 (925) 5552040
- 8 (925) 5552040
- Напишите нам
- Обратный звонок
Интернет магазин оборудования насосной, отопительной и водонагревательной техники №1
Определение избытка воздуха на рабочем котле. Токсичные вещества в дымовых газах и меры защиты. Расход воздуха на горение котла
|
Почтовые индексы ТиНАО
Суть процесса горения и условия, необходимые для полного сгорания топлива Горение — это сложный физико-химический процесс взаимодействия горючих компонентов топлива с окислителем, в частности, горение топлива — это реакция быстрого окисления его компонентов, сопровождающаяся интенсивным тепловыделением и резким повышением температуры. Для получения максимального КПД, т.е. для полного сгорания топлива, необходимы: непрерывный подвод топлива и воздуха в достаточном для горения количестве; хорошее перемешивание топлива с воздухом; высокая температура в топке; достаточное для горения время пребывания топливовоздушной смеси в топке. В отличие от твердых и жидких топлив, которые гореть не могут без предварительного подогрева до температуры воспламенения, газовое топливо может гореть и холодным, если оно перемешано с воздухом в концентрационных пределах границы воспламенения. Такую газовоздушную смесь можно воспламенить искрой, раскаленным телом, пламенем. Расход воздуха на сжигание природного газа. Коэффициент избытка воздуха Рассмотрим реакцию горения метана как основного компонента из числа составляющих природного газа: СН4 + 202 = С02 + 2Н20. Из уравнения этой реакции следует, что для окисления одной молекулы метана необходимы две молекулы кислорода, т.е. для полного сгорания 1 м3 метана требуется 2 м3 кислорода. В качестве окислителя при сжигании топлива в котельных агрегатах используется атмосферный воздух, который представляет собой сложную смесь веществ, в числе которых 21 об. % 02, 78 об. % N2 и 1 об. % С02, инертных газов и др. Для технических расчетов обычно принимают условный состав воздуха из двух компонентов: кислорода (21 об. и азота (79 об. %). С учетом такого состава воздуха для проведения любой реакции горения на воздухе для полного сжигания топлива потребуется воздуха по объему в 100/21 = 4,76 раза больше, чем кислорода. Следовательно, для приведенной реакции горения на полное сгорание 1 м3 метана (природного газа) должно быть израсходовано 2 м3 кислорода или 2 • 4,76 = 9,52 м3 воздуха. Это количество воздуха называется теоретическим расходом воздуха, необходимым для полного сгорания 1 м3 природного газа, и обозначается м3/м3. Однако на практике для обеспечения полного сгорания природного газа требуется расход воздуха несколько больший, чем теоретический. |
geyz.ru
|
Расчет ведем на 100 м3 природного газа. Для расчета горения природного газа составим таблицу 39. Таблица 39 Состав природного газа, кг
Определим расход кислорода при α=1,0. На сжигание составляющих газа потребуется кислорода, кг: С + О2 = СО2 54,0•32/12=144,0 2Н2 + О2 = 2Н2О 17,465•32/4=139,72 S + O2 = SO20,245•32/32=0,245 283,965 кг, или 198,78 м3 Теоретическая потребность воздуха, обогащенного до 25% О2, составит 198,78/0,25=795,10 м3. В нем содержится азота 795,10–198,78=596,32 м3, или 745,4 кг. Примем, что 1 м3 воздуха содержит 0,0117 м3 влаги. С воздухом поступит влаги 795,10•0,0117=9,30 м3, или 7,46 кг. Теоретический состав газов будет:
Теплота сгорания газа при α=1 равна 8659,6 ккал/м3. Определим количество кислорода, состав газов и теплоту сгорания газа при α=0,8: поступит кислорода 283,965•0,8=227,17 кг, или 159,02 м3, с ним азота 159,02/0,25•0,75=477,06 м3, или 596,3 кг. Всего поступит воздуха 159,02+477,06=636,08 м3. С воздухом поступит влаги 636,08•0,0117=7,44 м3=5,57 кг. Сжигание природного газа при недостатке кислорода и высоких температурах по данным И.В. Лаврова, характеризуется образованием СО, Н2 и Н2О и СО2, т.е. протекают реакции: СН4 + 1/2О2 = СО + 2Н2 + 8520 ккал; (1) С2Н6 + 2О2 = 2СО + Н2 + 2Н2О + 147860 ккал; (2) 2Н2 + О2 = 2Н2О + 115600 ккал; (3) 2СО + О2 = 2СО2 + 135280 ккал. (4) Согласно исследованиям Уральского политехнического института им. С.М. Кирова, при сжигании природного газа при высоких температурах (свыше 9000С) и коэффициенте избытка воздуха α=0,8 содержание водорода в отходящих газах не превышает 1% вследствие его высокой скорости сгорания. На основании этих данных определим состав и количество продуктов горения газа. По реакции (1) потребуется кислорода 63,2•16/16=63,2 кг. Образуется СО 63,2•28/16=110,6 кг; Н2 63,2•4/16=15,8 кг. По реакции (2) потребуется кислорода 8,25•64/30=17,6 кг. Образуется СО 8,25•56/30=15,4 кг; Н2 8,25•2/30=0,55 кг; Н2О 8,25•36/30=9,9 кг. По реакции (3) прореагирует 95% Н2, образующегося при сгорании метана и этана: (15,8+0,55)•0,95=15,53 кг. Израсходуется кислорода 15,53•32/4=124,24 кг. Образуется Н2О 15,53•36/4=139,77 кг. Останется свободного кислорода 227,17–63,2–17,6–124,24=22,13 кг. С этим кислородом прореагирует СО 22,13•56/32=38,73 кг. Образуется СО2 38,37•88/56=60,86 кг. По данным расчетов определим объем и состав отходящих газов при α=0,8:
Выход отходящих газов на 1,0 м3 природного газа будет равен 785,57/100=7,86 м3. Определим энтальпию газов. Количество тепла, выделяющееся по реакциям (1) – (4):
Энтальпия 1 м3 газов 616693/785,57=785 ккал. В действительности с учетом потерь тепла через кладку и на испарение влаги воздуха, а также реакций диссоциации энтальпия газов будет несколько ниже, но поскольку эти потери невелики, то в расчете они не учитываются. Определим температуру газов, вдуваемых в ванну, методом подбора по найденному выше составу, ккал/м3:
Находим температуру, при которой газы будут иметь энтальпию, равную 785 ккал: 827,28–783,38/100=0,439 ккал/0С; (785–783,38)/0,439=40С; tr=20040С. Для определения расхода газа, необходимого для переработки 100 кг шлаков, составим уравнение теплового баланса.
Приход тепла 1. С газами 785•7,86X ккал. 2. Тепло, вносимое жидким шлаком при температуре 11500С: 100•1150•0,29=33350 ккал. 3. С твердым пиритом 5•25•0,13=16,25 ккал. Всего приход тепла составит 33350+16,25+6170,1Х. Расход тепла 1. С жидким шлаком при 13000С: 87,9•1300•0,31=35423,7 ккал. 2. С жидким штейном при 12000С: 5,192•1200•0,21=1308,4 ккал. 3. Тепло, уносимое возгонами при 13000С: 11,1•1300•0,20=2886,0 ккал. 4. Расход тепла на эндотермические реакции: восстановление ZnO до Zn по реакции ZnO + СО = Zn + СО2 – 15534 ккал; 6,25/65,4•15534=1484,5 ккал; восстановление РbО до Рb по реакции РbО + СО = Рb + СО2 – 4764 ккал; 1,11•207,2•4764=25,5 ккал. Разложение пирита: FeS2 → FeS + S – 19800 ккал; 5/119,85•19800=826 ккал. С парами серы уйдет 0,808•1300•0,403=423,3 ккал. Всего расход тепла на эндотермические реакции составит 2759,3 ккал. 5. Тепло, уносимое газами при 13000С. На реакции восстановления ZnO и РbО израсходуется СО, кг:
Таким образом, количество СО2 составит 2,83•44/28=4,45 кг, или 2,26 м3. Определим тепло, уносимое газами, с учетом реакций восстановления, ккал:
6. Потери тепла с охлаждающей водой на основании данных практики примем равными 15% от прихода тепла: (33666,75+6170,1Х)•0,15=5004,9+925,5Х ккал. Всего расход тепла составит: 35423,7+1308,4+2886,0+2759,3+3803,9Х+575,2+5004,9+925,5Х=47957,5+4729,4Х. Решая уравнение 33666,25+6170,1Х=47957,5+4729,4Х, находим X=10,13 м3
Определим состав газов на выходе из ванны:
Определим энтальпию газов, выходящих из ванны при 13000С (таблица 25), ккал:
В среднем энтальпия 1 м3 газа равна 491,1 ккал. По данным расчетов составим тепловой баланс процесса на 100 кг шлаков (таблица 40).
ТАБЛИЦА 40 Тепловой баланс шлаковозгоночного процесса на 100 кг шлаков
Примечание. Невязка 0,01%. Определим количество кислорода, необходимого для дожигания газа, выходящего из ванны печи. В газе содержится: 4,82 м3 СО; 0,964 м3 Н2; 0,17 м3 S; 6,25 кг Zn; 1,1 кг Рb и 0,57 м3 S от пирита. Расход кислорода на дожигание составит, кг:
С кислородом, при условии, что дожигание осуществляется за счет подсоса воздуха, поступит азота 6,80/0,23•0,77=22,8 кг. Объем подсасываемого воздуха составит 6,80/32•22,4+22,8/28•22,4=22,8 м3≈23,0 м3. В нем 23,0•0,21=4,80 м3 кислорода и 23,0•0,79=18,20 м3 азота. Примем, что дожигание происходит при α=1,1. Больший подсос нежелателен, так как перегружает пылеулавливающие устройства. Потребуется воздуха 23,0•1,1=25,30 м3. В нем 25,30•0,21=5,3 м3 кислорода; 25,30•0,79=20,00 м3 азота и 25,30•0,0117=0,29 м3 влаги. От дожигания газа образуется:
Выделится тепла при образовании, ккал:
Газы на входе в котел-утилизатор после дожигания будут иметь следующий состав:
В газах содержится тепла 39102,2+21111,1=60213,3 ккал, или на 1 м3 60213,3/102,36=588,23 ккал. С учетом потерь тепла в кессонах колошника, равных 15%, энтальпия газов будет составлять 588,2–0,15•588,2=500,0 ккал. Методом подбора определим температуру газов, поступающих в котел-утилизатор (таблица 25). Задаем для этого две возможные температуры (1400 и 13000С) и производим подсчет, ккал/м3:.
Запас тепла в полученных нами газах (500,0 ккал) ближе к подсчету для 13000С. Корректируем полученные данные и находим температуру газов: (500,0–491,64)/(539,99–496,57)•0,01+1300=13190С.
Рекомендуемые страницы: Воспользуйтесь поиском по сайту: ©2015- 2018 megalektsii.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. |
megalektsii.ru
| АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника | ⇐ ПредыдущаяСтр 7 из 18Следующая ⇒
Минимальное количество воздуха, необходимого для полного сгорания единицы массы (кг) или объема (м3) горючего вещества, называется теоретически необходимым и обозначается VI.В табл. 1 приведены значения VIдля различных горючих веществ при нормальных условиях (0°С и 101,3 кПа). Значения величин, приведенных для древесины, торфа, бензина, керосина, нефти и водяного газа, являются средними, так как состав этих горючих материалов непостоянен. Вид формулы для расчета теоретически необходимого количества воздуха зависит от состава горючего вещества. Таблица 1. Теоретически необходимое количество воздухадля полного сгорания веществ
Горючее вещество — индивидуальное химическое соединение. Для таких горючих веществ независимо от их агрегатного состояния теоретически необходимое количество воздуха определяется из уравнений реакции горения. На m кмоль горючего вещества приходится пкмоль кислорода и азота из уравнения реакции горения. Обозначив массу (в кг) горючего вещества, численно равную молекулярной массе его, через М, составляют пропорцию тМ кг—n 22,4 м3 1 кг—VB0 м3 где 22,4 — объем 1 кмоль газов (при О °С и 101325 Па). Теоретически необходимый объем воздуха для сгорания 1 кг вещества равен (из пропорции) (1) Если объем воздуха, полученный по формуле (1), необходимо привести к иным условиям, то пользуются формулой (2),
где Т — заданная температура газов, К; р — заданное давление, Па. Теоретически необходимый объем воздуха для сгорания 1 м3 горючих газов определяется по формуле V°B = n/m (3) Пример 1. Определить объем воздуха, необходимый для сгорания 1 кг бензола при 20 оС и давлении 99992 Па. Составляем уравнение реакции горения бензола в воздухе C6H6 + 7,5O2 + 7,5.3,76N2 = 6CO2 + 3h3O + 28,2N2 Согласно уравнению реакции на горение 1 кмоля бензола требуется n=7,5+7,5-3,76=35,7 кмоля воздуха. Молекулярная масса бензола 78. По уравнению (1) определяем теоретически необходимый объем воздуха для сгорания 1 кмоля бензола при нормальных условиях м3/кг. При заданных условиях этот объем будет равен [уравнение (2)} м3/кг. Пример 2. Определить объем воздуха, необходимый для сгорания 4 м3 ацетилена. Составляем уравнение реакции горения ацетилена в воздухе С2Н2 + 2,5О2 + 2,5-3,76Nj = 2СОг + Н2О+ 9,4N2 Согласно уравнению реакции, на горение 1 кмоля ацетилена необходимо 2,5+2,5-3,76=11,9 кмолей воздуха. Определяем объем воздуха, необходимый для горения 4 м3 ацетилена . Горючее вещество — сложная смесь химических соединений. Такими веществами являются древесина, торф, каменный уголь и др. Для определения теоретически необходимого объема воздуха нужно знать элементный состав горючего вещества, выраженный в массовых процентах, т. е. содержание С, Н, О, S, N, золы (А), влаги (W). Элементный состав вещества определяют в аналитической лаборатории. Чтобы рассчитать , запишем уравнение реакции горения углерода, водорода и серы и массовое соотношение реагирующих веществ С + О2 = СО2 à+ О2 = 2Н2О S + О2 = SO3 12+32=44 4 + 32 = 36 32 + 32 = 64 Если для сгорания 12 кг углерода требуется 32 кг кислорода, то для 0,01 кг углерода, т. е. 1% (масс.) его потребуется кислорода 0,01-32/12 = 0,01-8/3 кг, для водорода соответственно потребуется 0,01-32/4 = 0,01-8 кг и для серы 0,01 -32/32 =0,01•1 кг кислорода. Для полного сгорания 1 кг горючего вещества потребуется кислорода (в кг) , где [С], [Н], [S], [О]—содержание углерода, водорода, серы и кислорода в горючем веществе, % (масс). На вычисленное количество кислорода в воздухе приходится в 77/23 раза больше азота. Сумма азота и кислорода составляет массу воздуха L\ (в кг), необходимую для горения 1 кг вещества После преобразования получим . (4) Чтобы выразить количество воздуха в объемных единицах, нужно правую часть выражения (4) разделить на массу 1м3 воздуха при нормальных условиях, т. е. на 1,293 кг/м3. В результате получим . (5) Пример 3. Определить объем воздуха, необходимый для сгорания 5 кг торфа, состоящего из 40,0% С, 4,0% Н, 13,0% О и 20,0% N; А= 10%; W=13,0%. Азот, зола и влага горючего вещества при определении количества воздуха не учитываются, так как они не принимают участия в реакции. Объем воздуха, необходимый для сгорания 1 кг торфа, определяем по формуле (5) м3/кг. Для сгорания 5 кг торфа потребуется воздуха 4,3.5=21,5 м3. Горючее вещество — смесь газов. К этой группе веществ относятся горючие газы, например природный, доменный, коксовый и др. Все они в том или ином количестве содержат СО, СН4, Н2, h3S, C2h5 и др. Состав горючих газов обычно выражают в объемных процентах. Для вывода формулы расчета VIнапишем уравнение реакции горения наиболее распространенных газов: СН4 + 2О2 = СО2 + 2Н2О h3S + 1, 5О2 = Н2О + SO2 2СО + О2 = 2СО2 2На + О2 = 2Н2О Если для сгорания 1 м3 метана требуется 2 м3 кислорода, как это видно из уравнения, то для сгорания 0,01 м3 метана, т. е. 1% (об.) потребуется 0,01.2 м3 кислорода. Для сгорания 1 м3 оксида углерода потребуется 0,01/2 м3 кислорода, такое же количество кислорода потребуется для сгорания 1 м3 водорода, а для сгорания сероводорода необходимо 0,01.1,5 м3 кислорода. Для полного сгорания 1 м3 горючего газа потребуется кислорода (в м3) ,
где [СН4], [Н2], [СО], [h3S] и [О2] — содержание метана, водорода, оксида углерода, сероводорода и кислорода, % (об.). В воздухе на этот объем кислорода приходится в 79/21 раза больше азота. Сумма азота и кислорода составляет объем (м3) воздуха, необходимый для сгорания 1 м3 газа . |
mykonspekts.ru
| АрхеологияАрхитектураАстрономияАудитБиологияБотаникаБухгалтерский учётВойное делоГенетикаГеографияГеологияДизайнИскусствоИсторияКиноКулинарияКультураЛитератураМатематикаМедицинаМеталлургияМифологияМузыкаПсихологияРелигияСпортСтроительствоТехникаТранспортТуризмУсадьбаФизикаФотографияХимияЭкологияЭлектричествоЭлектроникаЭнергетика | В расчетах принимают следующий состав сухого воздуха: азот – 79,0%, кислород – 21,0% по объему. Теоретически необходимый для горения расход сухого воздуха (L0) рассчитывают по следующим формулам: для твердого и жидкого топлива
для природного газа
Достаточная полнота смешивания потоков топлива и воздуха обеспечиваются при некотором избытке воздуха. Действительный расход сухого воздуха (Lд) равен:
где a – коэффициент избытка воздуха. Минимальные допустимые значения a зависят от вида сжигаемого топлива, способа сжигания, конструкции топливосжигающих устройств и условий работы печи. Для газа и мазута a = 1,05–1,2; для пылевидного твердого топлива a = 1,20–1,25; при слоевом сжигании углей, антрацита и торфа в механических топках с непрерывной подачей топлива и золоудалением a = 1,3–1,4. Для снижения температуры продуктов горения топлива (ПГТ) по сравнению с теоретической температурой принимают бóльшие значения a: до 1,5 и более. Пары воды, содержащиеся в атмосферном воздухе, незначительно увеличивают его расход по сравнению с сухим воздухом. Количество этой влаги учитывают с помощью влагосодержания атмосферного воздуха, выраженного в массовых %. Расход атмосферного воздуха (Lд’) при влагосодержании d (г/кг сухого воздуха) равен:
Влагосодержание d (г/кг сухого воздуха) можно определить по i–d-диаграмме Рамзина или по справочным таблицам [1], зная значения среднегодовой относительной влажности воздуха (j) и температуры для данной местности. Можно принять d = 10 г/кг сухого воздуха (при 20ºС и j = 60%). Объем продуктов горения топлива При полном сгорании любого топлива образуются следующие газообразные продукты: СО2, Н2Огаз, N2, SО2. Обычно горение происходит с избытком воздуха, поэтому в ПГТ присутствует О2, содержание которого зависит от коэффициента избытка воздуха a. Объемы дымовых газов по отдельности рассчитывают по формулам: для природного газа
для твердого и жидкого топлива
где wпар – количество пара, вводимого для распыления жидкого топлива в форсунках высокого давления, кг/кг топл.;
Объем кислорода VО2рассчитывают по формуле (17). Общий объем продуктов горения топлива рассчитывают по формуле:
Температура горения При выполнении расчетов определяют действительную температуру дымовых газов при данных условиях горения топлива и сравнивают ее с заданной температурой технологического процесса, чтобы проверить, правильно ли выбрано топливо и условия его горения. При необходимости изменяют условия горения (величину a, температуру подогрева вторичного воздуха) и повторяют расчеты. Рассчитывают общее теплосодержание продуктов горения топлива по формуле:
где k – доля вторичного (подогреваемого) воздуха на горение; iвозд = Свозд·tвозд – теплосодержание вторичного воздуха, которое определяют по линии воздуха на i–t-диаграмме при данной tвозд (рис. 1), iтопл = Стопл·tтопл – теплосодержание подогретого топлива (ССН4 = 1,55 кДж/(м3 К), Смазут = 1,88 – 2,05 кДж/(кг К), Суголь = 0,92 кДж/(кг К)), (Свозд, Стопл, ССН4, Смазут, Суголь×– удельная теплоемкость воздуха, топлива, метана, мазута, угля соответственно). Если воздух и топливо не подогревают, вторым и третьим слагаемыми можно пренебречь; qдисс – теплота диссоциации СО2 и Н2О. Потерями на диссоциацию СО2 и Н2О можно пренебречь, если пользоваться i–t-диаграммой, построенной с учетом диссоциации (сплошные линии на рис. 2). Рассчитывают действительное теплосодержание ПГТ с учетом пирометрического коэффициента h на потери тепла от ПГТ в процессе теплообмена с окружающими их поверхностями: i´ общ = h · i общ. Значения h зависят от вида топлива и типа печи, т.е. типа топливосжигающих устройств (горелок или форсунок), они приведены в табл. 1. Таблица 1. Пирометрический коэффициент для различных типов печей и видов топлива
С помощью i–t-диаграммы (рис. 1, 2) находят значение действительной температуры продуктов горения топлива при данных условиях горения.
|
studopedya.ru
Расчет объемов энтальпий воздуха и продуктов сгорания. Определение расхода топлива, газов и воздуха на котел
Министерство образования и науки Российской Федерации
Новосибирский государственный технический университет
Кафедра ТЭС
Расчетно-графическая работа по дисциплине
котельные установки и пароперегреватели
«Расчет объемов энтальпий воздуха и продуктов сгорания. Определение расхода топлива, газов и воздуха на котел»
Факультет: ЭН
Группа: ТЭ-21
Выполнил: Дугушкин Д.
Проверил: Баранов В. Н.
Новосибирск 2005
Содержание
Содержание 2
Исходные данные 3
Объемы воздуха продуктов сгорания 4
Энтальпии воздуха и продуктов сгорания 9
Тепловой баланс котла и определение расхода топлива 11
Расходы воздуха и газов 12
Литература 14
Исходные данные
| Тип котла | Производительность | Продувка | Давление за котлом | Температура за котлом | Давление в барабане | Давление питательной воды |
| D, т/ч | Dпр, % | Pпп, кгс/см2 | t, ºС | Pδ, кгс/см2 | Pпв, кгс/см2 | |
| ТПЕ-209 | 670 | 1,5 | 140 | 545 | 166 | 165 |
| Температура уходящих газов | Избыток воздуха в топке | Температура газов на выходе из топки | Температура газов за пароперегревателем | Температура газов за экономайзером | Температура питательной воды | Количество ступеней экономайзера | Количество ступеней воздухоподогревателя |
| υух, ºС | αт |
|
|
| tпв, ºС | ||
| 137 | 1,2 | 1060 | 570 | 270 | 244 | 2 | 2 |
| Наименование бассейна, месторождения | Марка топлива | Рабочая масса топлива, % |
|
|
| |||||||
|
|
|
|
|
|
|
|
| |||||
| Артемовский | БЗ | 24,0 | 24,0 | 0,2 | 0,1 | 35,7 | 2,9 | 0,7 | 12,1 | 3180 | 50,0 | 1130 |
1. Объемы воздуха продуктов сгорания
1.1 Объем воздуха, теоретически необходимый для полного сгорания твердого топлива.
1.2 Теоретический объем азота
1.3 Теоретический объем водяных паров
1.4 Объем трехатомных газов
1.5 Коэффициент избытка воздуха
1.5.1 Коэффициент избытка воздуха за ширмовым пароперегревателем (фестоном)
1.5.2 Коэффициент избытка воздуха за конвективным пароперегревателем
1.5.3 Коэффициент избытка воздуха за второй ступенью водяного экономайзера
1.5.4 Коэффициент избытка воздуха за второй ступенью воздухоподогревателя
1.5.5 Коэффициент избытка воздуха за первой ступенью водяного экономайзера
1.5.6 Коэффициент избытка воздуха за первой ступенью воздухоподогревателя
1.6 Действительный объем водяных паров
1.6.1 Действительный объем водяных паров в топке за фестоном
1.6.2 Действительный объем водяных паров за конвективным пароперегревателем
1.6.3 Действительный объем водяных паров за второй ступенью водяного экономайзера
1.6.4 Действительный объем водяных паров за второй ступенью воздухоподогревателя
1.6.5 Действительный объем водяных паров за первой ступенью водяного экономайзера
1.6.6 Действительный объем водяных паров за первой ступенью воздухоподогревателя
1.7 Полный объем продуктов сгорания
1.7.1 Полный объем продуктов сгорания в топке за фестоном
1.7.2 Полный объем продуктов сгорания за конвективным пароперегревателем
1.7.3 Полный объем продуктов сгорания за второй ступенью водяного экономайзера
1.7.4 Полный объем продуктов сгорания за второй ступенью воздухоподогревателя
1.7.5 Полный объем продуктов сгорания за66 первой ступенью водяного экономайзера
1.7.6 Полный объем продуктов сгорания за первой ступенью воздухоподогревателя
1.8 Объемные доли трехатомных газов
1.8.1 Объемные доли трехатомных газов и водяных паров в топке за фестоном
1.8.2 Объемные доли трехатомных газов и водяных паров за конвективным пароперегревателем
1.8.3 Объемные доли трехатомных газов и водяных паров за второй ступенью водяного экономайзера
1.8.4 Объемные доли трехатомных газов и водяных паров за второй ступенью воздухоподогревателя
1.8.5 Объемные доли трехатомных газов и водяных паров за первой ступенью водяного экономайзера
1.8.6 Объемные доли трехатомных газов и водяных паров за первой ступенью воздухоподогревателя
1.9 Масса дымовых газов и концентрация золы в дымовых газах
1.9.1 Масса дымовых газов и концентрация золы в дымовых газах в топке за фестоном
1.9.2 Масса дымовых газов и концентрация золы в дымовых газах за конвективным пароперегревателем
1.9.3 Масса дымовых газов и концентрация золы в дымовых газах за второй ступенью водяного экономайзера
1.9.4 Масса дымовых газов и концентрация золы в дымовых газах за второй ступенью воздухоподогревателя
1.9.5 Масса дымовых газов и концентрация золы в дымовых газах за первой ступенью водяного экономайзера
1.9.6 Масса дымовых газов и концентрация золы в дымовых газах за первой ступенью воздухоподогревателя
2. Энтальпии воздуха и продуктов сгорания
2.1. Энтальпия теоретически необходимого воздуха
2.1.1 Энтальпия теоретически необходимого воздуха на выходе из топки
2.1.2 Энтальпия теоретически необходимого воздуха на выходе за пароперегревателем
2.1.3 Энтальпия теоретически необходимого воздуха на выходе за водяным экономайзером
2.1.4 Энтальпия теоретически необходимого воздуха в уходящих газах
2.2 Энтальпия теоретически объема дымовых газов
2.2.1 Энтальпия теоретического объёма дымовых газов на выходе из топки
2.2.2 Энтальпия теоретического объёма дымовых газов за пароперегревателем
2.2.3 Энтальпия теоретического объёма дымовых газов за водяным экономайзером
2.2.4 Энтальпия теоретического объёма дымовых газов на выходе
2.3 Энтальпия золы в дымовых газах
2.3.1 Энтальпия золы в дымовых газах на выходе из топки
2.3.2 Энтальпия золы в дымовых газах за пароперегревателем
2.3.3 Энтальпия золы в дымовых газах за экономайзером
2.3.4 Энтальпия золы в дымовых газах на выходе
2.4 Энтальпия действительного объёма продуктов сгорания
2.4.1 Энтальпия действительного объёма продуктов сгорания на выходе из топки
2.4.2 Энтальпия действительного объёма продуктов сгорания за пароперегревателем
2.4.3 Энтальпия действительного объёма продуктов сгорания за экономайзером
2.4.4 Энтальпия действительного объёма продуктов сгорания в уходящих газах
3. Тепловой баланс котла и определение расхода топлива
3.1 Потери тепла в котлоагрегате
3.1.1 Потери тепла от химической неполноты сгорания при сжигании твёрдых топлив в топках с твёрдым шлакоудалением принимаем равной нулю.
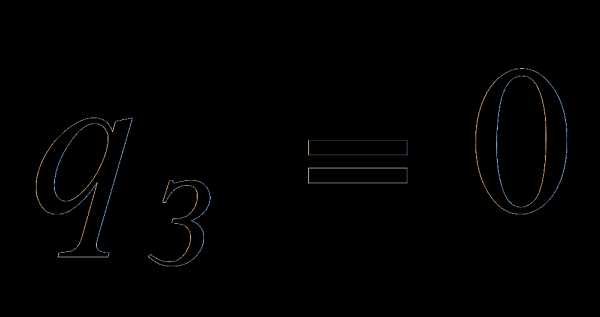
3.1.2 Потери тепла от механической неполноты сгорания (табл. 4.5 [1]).
3.1.3 Потери тепла от наружного охлаждения (табл. 4.6 [1]).
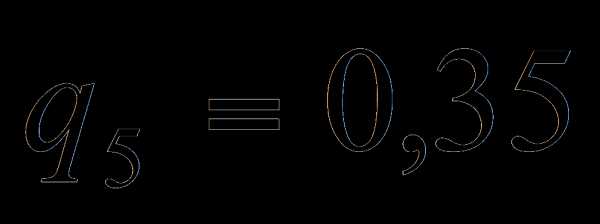
3.1.4 Потери с физическим теплом шлака
24,0<31,8 => 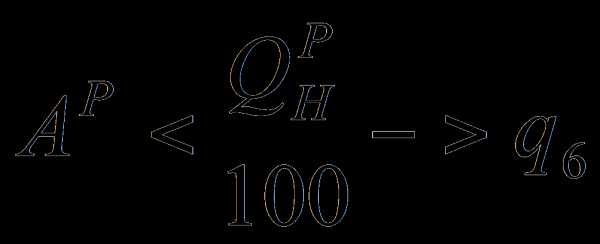 пренебрегаем
пренебрегаем
3.1.5 Потери тепла с уходящими газами
3.2 КПД котлоагрегата
3.4 Тепло, полезно используемое в котлоагрегате
3.5 Полный расход топлива, подаваемого в топку котла
3.6 Расчётный расход топлива, подаваемого в топку котла
4. Расходы воздуха и газов
4.1 Количество холодного воздуха засасываемого дутьевыми вентиляторами
4.2 Расход газов у дымососов
Таблица 1. Средние объемные характеристики продуктов горения
| Расчетные формулы | Размерность |
| |||||
| газоходы котла | |||||||
| Топка, ширма, фестон | Конвективный пароперегреватель | Водяной экономайзер II ступени | Воздухоподогреватель II ступени | Водяной экономайзер I ступени | Воздухоподогреватель I ступени | ||
| Коэффициент избытка воздуха ха поверхностью нагрева, | - | 1,2 | 1,23 | 1,25 | 1,28 | 1,3 | 1,33 |
| Коэффициент избытка воздуха, средний по газоходу, | - | 1,2 | 1,215 | 1,24 | 1,265 | 1,29 | 1,315 |
| Объем водяных паров, | 0,688 | 0,689 | 0,691 | 0,692 | 0,694 | 0,695 | |
| Объем дымовых газов, | 4,875 | 4,929 | 5,02 | 5,109 | 5,2 | 5,29 | |
| Объемная доля трехатомных газов, | - | 0,137 | 0,136 | 0,133 | 0,131 | 0,128 | 0,126 |
| Объемная доля водяных паров, | - | 0,141 | 0,140 | 0,138 | 0,135 | 0,133 | 0,131 |
| Суммарная доля трехатомных газов и водяных паров | - | 0,278 | 0,276 | 0,271 | 0,266 | 0,261 | 0,257 |
| Масса дымовых газов | 6,322 | 6,392 | 6,507 | 6,623 | 6,739 | 6,855 | |
| Концентрация золы в дымовых газах
| 0,036 | 0,036 | 0,035 | 0,034 | 0,034 | 0,033 | |
Литература
1. Методическое указание №1475 621 К731 "Котельные установки"; под ред. Баранова В.Н.,
Новосибирск, 2002 г.
nreferat.ru
Расход воздуха на горение - Справочник химика 21
Расход воздуха на горение [c.21]Другие характеристики горения. При расчетах горения топлива наиболее употребительны следующие характеристики теоретический расход воздуха на горение, объем уходящих газов, предельное содержание СО2, скорость горения, температура воспламенения, концентрационные пределы воспламенения и температура пламени (табл. 16). [c.57]
Л — удельный расход воздуха на горение летучих веществ, кг/кг. [c.198]
Расход воздуха на горение, м /ч....... 1200—1300 [c.131]
Объемные расходы воздуха на горение. Для определения объемных расходов воздуха и количеств получающихся топочных газов принимают следующие состав воздуха и удельные веса отдельных газов [c.42]
Расход воздуха на горение топлива и пыли и дожиг летучих веществ рассчитывают в стехиометрическом соотношении, так как в прокалочной печи среда восстановительная (за исключением топки). [c.196]
Коэффициент избытка воздуха а Расход воздуха на горение. . [c.367]
Расчет процесса горения топлива выполняют по общеизвестной методике и в результате этого расчета определяют расход воздуха на горение, кг/кг топлива выход дымовых газов, кг/кг топлива и мVкг топлива средняя теплоемкость дымовых газов, кДж/(кг К) зависимость энтальпии дымовых газов ( ж/кг топлива) от их температуры (фафик Гриневецкого). [c.412]Выход кокса и его теплота сгорания (с учетом неполноты сгорания) известны количество дымовых газов определяется по расходу воздуха на горение кокса температурами реакции и регенерации обычно задаются на основании опытных данных. Таким образом, из уравнения (37) определяется масса катализатора Скат., а отсюда и величина в уравнении (36). [c.193]
Расход сырья не изменяется (режим 1). При этом увеличивается выход техуглерода и уменьшается расход воздуха на горение и воды на охлаждение сажегазовой смеси воды и также [c.100]
Действительный расход воздуха на горение, м /ч, д = а 5, [c.38]
Расход первичного воздуха принимается равным 15% общего расхода воздуха на горение при нормальной производительности независимо от нагрузки для поддержания постоянной скорости на выходе из горелок. [c.467]
Согласно проекту Ленгипрогаза предусмотрено, что часть подогретого в рекуператоре воздуха смешивается со свежим, поступающим из атмосферы, холодным воздухом с таким расчетом, что температура смеси должна быть не ниже 70° С (с целью предотвращения конденсации сернистых соединений). Однако средняя температура воздуха, вступающего в рекуператор, 158° С, а температура воздуха, выходящего из рекуператора, 186° С вместо расчетных 235° С. В этом случае имеет место рециркуляция чрезмерно большого объема воздуха — 125 000 нм /ч при расходе воздуха на горение 18 400 нм /ч, т. е. кратность равна 6,8. [c.129]
В циклонных реакторах, показанных на рис. 51—54, воздух, необходимый для окисления горючих составляющих сточной воды, может вводиться совместно с воздухом для горения топлива через горелочные устройства, что целесообразно при невысоких концентрациях горючих веществ в исходной сточной воде (класс/). Когда концентрация горючих веществ в сточной воде такова, что расход воздуха на их окисление превышает 50% расхода воздуха на горение топлива (сточные воды класса 2), этот воздух необходимо вводить в циклонный реактор отдельно в качестве вторичного (см. рис. 54, а). При этом повышается устойчивость горения топлива в головной части реактора. [c.143]
Номинальный расход воздуха на горение и нагрев, тыс. м7ч........2,3 [c.252]
Понизить интенсивность горения, увеличить подачу воздуха Увеличить расход воздуха на горение для полного сгорания газа [c.64]
Воздушные низкого давления и ротационные (форсуночные агрегаты) Сжатый воздух, р=3,5- -- 10,0 кн/м В=(0,6н-0,85)1 кг воздуха на 1 кг топлива (1—теоретический расход воздуха на горение, кг на 1 кг топлива). Для ротационных форсунок >=(0,2- -- 0.6) Роквелл, Оргэнергонефти, (Стальпроекта, Союзтеплостроя, Карабина, ротационные вращающиеся (форсуночные агрегаты) Высокая экономичность, высокий пирометрический эффект в силу полноты сгорания и малого коэффициента избытка воздуха, легкая возможность автоматизации Значительные геометрические размеры форсунок Промышленные печи (кроме регенеративных) [c.64]
Расход воздуха на распыление мазута,. . 160 Расход воздуха на горение, м /ч....... 1100 [c.271]
В схему узла регулирования соотношения, помимо экстремального регулятора, включают регулятор соотношения с расходомерами-датчиками на мазуто- и воздухопроводах и исполнительный механизм, воздействующий на поворотную заслонку на воздухопроводе. Экстремальный регулятор получает сигнал от потенциометра, измеряющего вместе с термопарой температуру в печи, и в зависимости от этого сигнала корректирует положение задатчика на регуляторе соотношения. Таким образом, экстремальный регулятор устанавливает расход воздуха на горение на уровне, обеспечивающем максимальную температуру при данном расходе топлива. [c.287]
Сравнительно малые колебания величины р для твердых топлив и соответственно малая разница между теоретическими объемами У°с.г и У°в, несмотря на исключительно большие различия в горючей массе ( =2- 90%) и влажности сравниваемых топлив ( °=0,5т-32), объясняется следующим. Во-первых, изменения состава горючей массы твердых топлив сопровождаются двумя явлениями, действующими в сторону сближения значений объемов У с.г и У°в- Так, с ростом содержания летучих и водорода в тоцливе объем сухих продуктов сгорания уменьшается ( У о.г) за счет расхода части кислорода воздуха на горение водорода одновременно с этим уменьшается расход воздуха на горение ( У°в) за счет сопутствующего увеличения содержания свободного кислорода в горючей массе топлива. Во-вторых, изменения влажности топлива совершенно не сказываются на величине р. Так, при увеличении приведенной влажности сжигаемого топлива возрастет приведенный объем сухих продуктов сгорания за счет расхода части топлива на испарение влаги в топке, но одновременно в такой же мере относительно возрастет расход воздуха на горение. [c.107]
При увеличении содержания в топливе минв ральной массы, образующей золу, снижается теплотворная способ-ноеть топлива, так как при этом уменьшается содержание горючих элементов. Однако, поскольку с уменьшением содержания горючих элементов в топливе соответственно снижается расход воздуха на горение и, следовательно, объем образующихся продуктов горения, то жаро произво-дительность при этом не меняется, если, разумеется, не учитывать расход тепла на нагрев минеральной массы топлива. [c.32]
Система автоматизированного управления режимом ра ванной печи обеспечивает автоматический контроль следующ технологических параметров температуры газовой среды печц температуры стекломассы, температуры отходящих дымовых гд зов, температуры топлива и воздуха, подаваемого на горени давления в печи, разрежения отходящих дымовых газов, давления мазута и воздуха для его распыления, расхода мазута, расхода воздуха на горение топлива, уровня стекломассы и др. Систем автоматизированного управления механизмами линии выработки силикат-глыбы предусматривает сигнализацию верхнего и нижнего уровня в бункере шихты над загрузчиками и управления работой формующих конвейеров. [c.140]
Однако средняя температура воздуха, поступающего рекуператор, равна 1O8°I (вместо 70°С), а тем пература воздуха, выходящего из рекуператора, 1 86°С, вместо расчетных 235°С. В этом случае рециркулирует большой объем возуха (125 000 нм ч) при расходе воздуха на горение 18 400 нм ч, т. е. кратность равна 6,8. 40 [c.40]
Здесь в дополнение к ранее принятым обозначениям а — коэффициент, расхода воздуха и — теоретический расход воздуха на горение газа, м /м к — опытный коэффициент, зависящий от общего числа газовьшускных отверстий. При однорядной подаче газа [c.161]
Разложение карбонатов определяется величиной упругости их диссоциации зависящей от температуры. До тех пор, пока упругость диссоциации меньше значения парциального давления углекислоты в окружающей газовой среде, разложение карбоната невозможно. Обычно в продуктах сгорания, просасываемых через слой окатышей, содержится около 10 % СО . Тогда парциальное давление диоксида ушерода составит в среднем 10 кПа, а упругость диссоциации известняка станет равной этой величине при 771 °С. При уменьшении концентрации диоксида угаерода в газе (например, при увеличении коэффициента расхода воздуха на горение) температура разложения известняка снижается. Так, при парциальном давлении СО в газе 5 кПа эта температура равна 736 °С, а при 1 кПа — 662 °С. [c.203]
Теоретический расход воздуха на горение изменяется в нределах 0,9— 1,2 м ]кг сланца в зависимости от содержания керогена. Общий характер влияния изменения соотношения воздух слаиец такой же, как и при любом другом топливе. При количестве воздуха, подаваемого на горение, меньшем,чем требуется для полного сгорания, образуется окись углерода и в дымовых газах обнаруживается присутствие несгоревших частиц углерода. С увеличением подачи воздуха содержадие окиси уг.перода в дымовых газах снижалось и достигались условия, при которых и чeзaJra темная окраска дыма. Одновременно наблюдалось повышение температуры как слоя, так и дымовых газов. При дальнейшем увеличении количества подаваемого воздуха происходили обратные изменения вследствие охлаждения слоя воздл хом и разбавления газов. Оптимальные условия достигались при избытке воздуха около 40% по сравнению с теоретическим, что является обычной цифрой для всех твердых тоилив. [c.485]
Основные технические характеристики котла максимальная теплопроизводительность 1 Гкал/ч номинальный расход природного газа 131 м /ч при расчетном кпд не менее 90% температура воды на выходе не более 95, на входе расчетная при работе на отопление 75, минимальная — 50° С. Давление газа перед приборами автоматики, кгс/м , не более 300, не менее 150 давлелие воздуха за вентилятором 200—300 кгс/м . Расход воздуха на горение при а = 1,05 не более 1300 м /ч. Теплосъем с 1 м поверхности нагрева при номинальной нагрузке 55 Мкал/(м -ч), масса металлоконструкций котла 958 кг. [c.418]
Подогрев газового топлива с высоко11 теплотой сгорания (такого как природные газы) с целью экономии топлива нецелесообразен масса на порядок меньше массы дутьевого воздуха, а подогрев горючих газов связан с техническими трудностями (применение особо газоплотных подогревателей, возможность отложения углерода на поверхностях нагрева). При использовании для отопления реакторов газов с низкой теплото11 сгорания (типа доменного), когда расход воздуха на горение одного порядка с расходом газа (илп менее его), целесообразно применять подогрев одновременно дутьевого воздуха и газового топлива. [c.169]
Исходные данные. Топливо — природный газ. Параметры теплота сгоранпя = 46928 кДж/м теоретический расход воздуха на горение 12,3 м /м плотность газа рг = 0,96 кг/м температура газа г=Ю°С избыточное давление газа перед горелкой р1г = 2000 Па. Расход газа при номинальной тепловой мощности У°г = 0,0124 м /с. Необходимый коэффициент рабочего регулирования горелки по тепловой мощности йраб.рег = 6. Коэффициент расхода воздуха а = 1,04. Параметры дутьевого воздуха температура г в = 200 °С плотность рв = 0,746 кг/м . Параметры газовоздушной смеси температура /см=178°С плотность рсм = = 0,77 кг/м коэффициент температуропроводности асм = 51- 10 м /с нормальная скорость распространения пламени Нп = = 0,52 м/с. Избыточное давление в камере сгорания рксг = = —30 Па. [c.284]
chem21.info
| АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника | ⇐ ПредыдущаяСтр 3 из 16Следующая ⇒
В действительных условиях невозможно довести топливо до полного сгорания при теоретически необходимом объеме воздуха V° вследствие несовершенства перемешивания топлива с воздухом в большом топочном объеме за короткое время пребывания газов в нем (1—2 с). Поэтому для обеспечения достаточно полного сгорания топлива, удовлетворяющего экономическим показателям работы котлов, действительный объем воздуха всегда несколько больше теоретического. Отношение этих объемов называют коэффициентом избытка воздуха в продуктах сгорания а= Vв / V° Необходимый коэффициент избытка воздуха в топке ат зависит от сорта топлива, способа его сжигания и конструкции топочного устройства. Высокореакционное твердое топливо, отличающееся большим выходом летучих веществ, легче воспламеняется и быстрее сгорает, поэтому нуждается в меньшем избытке воздуха, чем топливо с малым выходом летучих. Эффективное перемешивание топлива с воздухом достигается в газовоздушных смесях, поэтому сжигание мазута и газового топлива требует наименьшего избытка воздуха. Разный избыток воздуха нужен при сжигании одного и того же топлива, но в разных топочных устройствах (например, в прямоточной или вихревой топочной камере), отличающихся эффективностью перемешивания. Уменьшение избытка воздуха дает экономию расхода энергии на привод тягодутьевых машин и повышает КПД котла, однако его снижение ниже расчетного значения ат ведет к быстрому росту недожога топлива и снижению экономичности котла. Для обеспечения при эксплуатации оптимальных условий горения топлива и минимума присосов воздуха по газовому тракту необходим постоянный контроль за избытками воздуха в газовом тракте. На электростанциях используют два метода определения этого показателя. Основным является метод прямого определения остаточного кислорода в потоке дымовых газов кислородомером. Определение содержания кислорода в газовой смеси основано на использовании магнитных свойств молекул кислорода, чем не обладают другие газы многокомпонентной газовой смеси. Вторым достаточно широко применяемым методом определения избытка воздуха в продуктах сгорания является его расчет на основе нахождения процентного содержания сухих трехатомных газов В газообразных выбросах электростанций безопасными составляющими для человека являются водяные пары, углекислый газ, кислород и азот. Остальные ингредиенты в той или иной мере являются вредными. Время существования газообразных вредных веществ в окружающей среде составляет от нескольких часов до нескольких суток. Многие из них постепенно разрушаются или преобразуются в безвредные под действием солнечной радиации и наличия кислорода в воздухе. Аэрозольные твердые частицы (сажа, пятиокись ванадия, бенз(а)пирен), оседая на поверхности земли, могут накапливаться и участвуют в приземной циркуляции атмосферы Степень опасности воздействия того или иного вещества на живой организм определяют через отношение действительной концентрации вещества С, мг/м3, к предельно допустимой концентрации (ПДК), мг/м3, в воздухе на уровне дыхания. В отличие от газа ЗОг, выбросы которого из котлов относятся к неуправляемому процессу и зависят только от содержания серы в топливе, концентрация окислов азота в дымовых газах в решающей степени определяется организацией топочного процесса. Окислы азота образуются главным образом за счет азота и кислорода воздуха в высокотемпературной области горения (при температурах более 1600°С) и в результате окисления собственного азота топлива (эта реакция протекает при температурах ниже 1600°С). Таким образом, главными факторами уменьшения образования N0* в топках являются снижение температурного уровня в зоне горения («низкотемпературное» горение) и уменьшение избытка воздуха. При этом следует помнить, что оба эти фактора в условиях неналаженной работы топки и горелок могут привести к образованию других не менее вредных веществ [например, сажи и бенз(а)пирена]. Выброс золовых частиц электростанциями составляет около 20% общего загрязнения атмосферы твердыми пылевыми частицами. С увеличением мощности тепловых электростанций и доли сжигания на них твердых топ-лив выбросы твердых фракций могут воз расти. В связи с этим актуальной становится задача глубокого улавливания золовых частиц перед удалением дымовых газов в атмосферу. В летучей золе после сжигания твердых топлив находится ряд вредных компонентов, таких как соединения, содержащие фтор и мышьяк, окислы ЗЮг, СаО. Улавливание золовых частиц на ТЭС чаще всего производится электрофильтрами. Для многих топлив, обладающих повышенным содержанием золо-вого остатка, степень очистки газов от золы должна быть не ниже 99%.
|
mykonspekts.ru

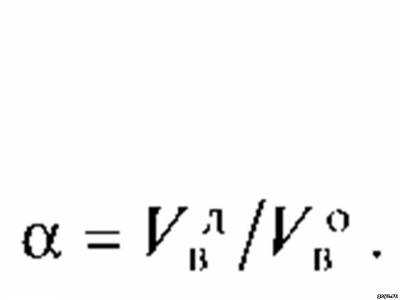 Коэффициент избытка воздуха в общем случае зависит от вида сжигаемого топлива, его состава, типа горелок, способа подачи Отношение действительного расхода воздуха подаваемого на сжигание топлива, к его теоретическому значению V° называют коэффициентом избытка воздуха воздуха, конструкции топочного устройства и т.д. Для сжигания природного газа обычно принимают а = 1,05... 1,15.
Коэффициент избытка воздуха в общем случае зависит от вида сжигаемого топлива, его состава, типа горелок, способа подачи Отношение действительного расхода воздуха подаваемого на сжигание топлива, к его теоретическому значению V° называют коэффициентом избытка воздуха воздуха, конструкции топочного устройства и т.д. Для сжигания природного газа обычно принимают а = 1,05... 1,15.
 , ккал/ кг
, ккал/ кг , %
, % , ºС
, ºС